Pengertian Bilangan Kuantum
Bilangan kuantum adalah suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat orbital dan elektron dalam orbital.
Bilangan kuantum menentukan :
1. Tingkat venergi utama atau jarak dari inti
2. Bentuk orbital
3. Orientasi
4. Spin elektron
Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Macam-macam Bilangan Kuantum
Untuk menjelaskan kedudukan elektron dibutuhkan empat macam bilangan kuantum. yaitu:
1. Bilangan kuantum utama (n) yang menyatakan tingkat energi.
2. Bilangan kuantum azimut (L) yang menyatakan bentuk orbital.
3. Bilangan kuantum magnetik (m) yang menyatakan orientasi orbital.
4. Bilangan kuantum spin (s) yang menyatakan arah perputaran (spin) elektron dalam suatu atom.
Penjelasan Bilangan Kuantum
1. Bilangan Kuantum Utama (n)

Untuk setiap subkulit diberi lambang berdasarkan harga bilangan kuantum l.
Lambang s, p, d, f diambil dari nama spektrum yang dihasilkan oleh logam alkali dari Li sampai dengan Cs yang terdiri dari empat deret, yaitu tajam (sharp), utama (principal), kabur (diffuse), dan dasar (fundamental). Sampai saat ini, elektron-elektron baru menempati subkulit-subkulit s, p, d, dan f. Sedangkan subkulit g, h, dan i belum terisi elektron.
Tabel di bawah ini menunjukan keterkaitan jumlah kulit dengan banyaknya subkulit serta jenis subkulit dalam suatu atom.
Bilangan kuantum adalah suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat orbital dan elektron dalam orbital.
Bilangan kuantum menentukan :
1. Tingkat venergi utama atau jarak dari inti
2. Bentuk orbital
3. Orientasi
4. Spin elektron
Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Macam-macam Bilangan Kuantum
Untuk menjelaskan kedudukan elektron dibutuhkan empat macam bilangan kuantum. yaitu:
1. Bilangan kuantum utama (n) yang menyatakan tingkat energi.
2. Bilangan kuantum azimut (L) yang menyatakan bentuk orbital.
3. Bilangan kuantum magnetik (m) yang menyatakan orientasi orbital.
4. Bilangan kuantum spin (s) yang menyatakan arah perputaran (spin) elektron dalam suatu atom.
Penjelasan Bilangan Kuantum
1. Bilangan Kuantum Utama (n)

2.
Bilangan Kuantum Azimuth (l)
Mekanika gelombang meramalkan bahwa
setiap kulit (tingkat energi) tersusun dari beberapa subkulit (subtingkat
energi) yang masing-masing subkulit tersebut dicirikan oleh bilangan kuantum azimuth yang diberi lambang (l).
Bilangan
kuantum azimut mempunyai harga dari 0 sampai dengan (n-1) untuk setiap n, dan
menunjukan letak elektron dalam subkulit. Setiap kulit terdiri dari subkulit
(jumlah subkulit tidak sama untuk setiap kulit elektron), dan setiap subkulit
dilambangkan berdasarkan pada harga bilangan kuantum azimut (l).
Untuk setiap subkulit diberi lambang berdasarkan harga bilangan kuantum l.
Lambang s, p, d, f diambil dari nama spektrum yang dihasilkan oleh logam alkali dari Li sampai dengan Cs yang terdiri dari empat deret, yaitu tajam (sharp), utama (principal), kabur (diffuse), dan dasar (fundamental). Sampai saat ini, elektron-elektron baru menempati subkulit-subkulit s, p, d, dan f. Sedangkan subkulit g, h, dan i belum terisi elektron.
Tabel di bawah ini menunjukan keterkaitan jumlah kulit dengan banyaknya subkulit serta jenis subkulit dalam suatu atom.
3.
Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) menyatakan
orbital khusus yang ditempati elektron pada suatu subkulit. Bilangan kuantum
magnetik juga menyatakan orientasi khusus dari orbital itu dalam ruang relatif terhadap inti. Nilai bilangan kuantum magnetik bergantung pada nilai bilangan
kuantum azimuth, yaitu semua bilangan bulat mulai dari –l sampai dengan +l,
termasuk 0.
Dari
tabel di atas terlihat bahwa nilai magnetik (m) diantara – l sampai + l (l =
bilangan kuantum azimut). Nilai bilangan kuantum magnetik suatu elektron
tergantung pada letak elektron tersebut dalam orbital. Nama-nama kotak di atas
sesuai dengan bilangan kuantum magnetiknya. Dan perlu diingat juga dengan mengabaikan tanda -/+ maka nilai m tidak mungkin lebih besar dari nilai l.
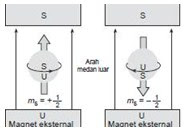
4.
Bilangan Kuantum Spin (s)
Sambil beredar mengintari inti, elektron juga
berputar pada sumbunya. Gerak berputar pada sumbu ini disebut rotasi.
Hanya ada dua kemungkinan arah rotasi elektron, yaitu searah atau berlawanan
arah jarum jam. Kedua arah yang berbeda itu dinyatakan dengan bilangan kuantum
spin (s) yang mempunyai nilai s = + 1/2 atau s =
– 1/2. Akibatnya satu orbital hanya dapat ditempati oleh maksimum dua elektron,
di mana kedua elektron itu haruslah mempunyai spin yang berlawanan, sehingga
menghasilkan medan magnet yang berlawanan pula. Medan magnet yang berlawanan
ini diperlukan untuk mengimbangi gaya tolak-menolak listrik yang ada (karena
muatan sejenis).
Hubungan keempat bilangan kuantum
Dapat
disimpulkan bahwa kedudukan suatu elektron dalam suatu atom dinyatakan oleh
empat bilangan kuantum, yaitu:







0 Response to "Bilangan Kuantum"
Posting Komentar